日本细胞治疗制备路径详解
摘要
了解日本再生医疗法规下的细胞制备两大路径:院内制备与CPC制度。本文深入解析两者的监管差异、优缺点及患者在选择细胞治疗方案时应考虑的关键因素。
在日本,细胞治疗的制备流程受到《再生医疗等安全性确保法》的严格监管,细胞治疗的制备路径主要分为“院内制备(备案型)”与“CPC制度(许可型)”。两者在监管强度、安全性与灵活性方面各有差异,患者在接受干细胞、免疫细胞或PRP疗法前,应了解两种主要的细胞加工路径:院内制备与CPC制度。
背景:再生医疗法下的细胞制备路径
根据《再生医疗等的安全性确保等相关法律》(2014年施行),所有用于细胞治疗的“特定细胞加工物”必须在符合规定的设施中制备,并接受厚生劳动省的监管。制备路径分为两类:
路径一:院内制备(备案型)
- 定义
- 指在医疗机构内部设立的细胞加工室,由该机构自行完成细胞采集、培养与回输。
- 向地方厚生局提交“特定细胞加工物等制造届出(备案)”,无需厚生劳动省许可。
- 优点
- 流程紧凑:采集、加工、治疗均在院内完成,减少运输时间与细胞损耗。
- 响应快速:适合个性化治疗或紧急处理。
- 成本较低:省去外包费用。
- 限制
- 监管相对宽松:需备案,原则上应满足GMP管理要求,但不经PMDA实地审查。
- 设施标准差异大:部分院所CPC等级不高,存在交叉污染风险。
- 适用范围有限:多用于第三种或第二种再生医疗(低至中风险)。
路径二:CPC制度(许可型)
- 定义
- 指由厚生劳动省许可的“特定细胞加工物等制造设施”,通常由CDMO企业或大型医院设立。
- 需提交“制造许可申请”,并接受PMDA实地审查,。
- 优点
- 高安全性与标准化:设施需符合GCTP(细胞治疗产品制造规范),清洁度达GMP要求(B+A 或 C+A 环境)。
- 质量可追溯:全流程记录、批次管理、病毒筛查等严格执行。
- 适用于高风险治疗:如使用iPS细胞、基因改造细胞等第一种再生医疗。
- 限制
- 流程复杂:细胞需运输至外部CPC,存在时间延迟与冷链风险。
- 成本较高:需支付加工费用与物流成本。
- 治疗周期较长:从采集到回输可能需数周。
开展情况
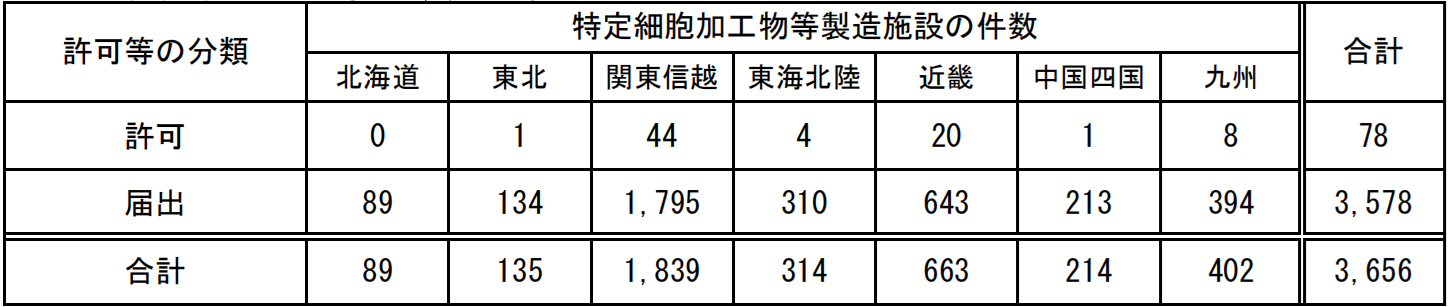
截止2025年6月,日本全国获取牌照的CPC共有78家,而院内制备(备案,日文为“届出”)则多达3656家。
结语
日本的细胞治疗制度在全球属于监管最严谨之一。 患者在选择治疗方案时,不仅要关注疗效,更应了解细胞制备路径背后的安全性与合规性。 无论是院内制备还是CPC制度,都必须在厚生劳动省的框架下进行备案或许可,否则将面临法律处罚。
参考:厚生劳动省关于特定細胞加工物等製造施設的说明。